"ما هو الكاثود والأنود؟
ما هو القطب What is an Electrode؟
تعريف الكاثود Definition of Cathode:
تعريف الأنود Definition of Anode:
ما الفرق بين الكاثود والأنود؟
شرح الاختلافات الرئيسية بين الأنود والكاثود:
ما هو الكاثود والأنود؟
الأنود والكاثود هما التصنيفان اللذان يتم فيهما تصنيف الأقطاب الكهربائية. الفرق الكبير بين الأنود والكاثود هو أنّه يحدث عند أكسدة الأنود. مقابل ذلك، يحدث الاختزال عند الكاثود. بشكل عام يعتبر الأنود بشكل خاص موجب والكاثود بشكل خاص سالب. لكن، سنتعرف على أنّ التمايز بين الأنود والكاثود لا يتم فقط وفقًا لنوع القطبية.
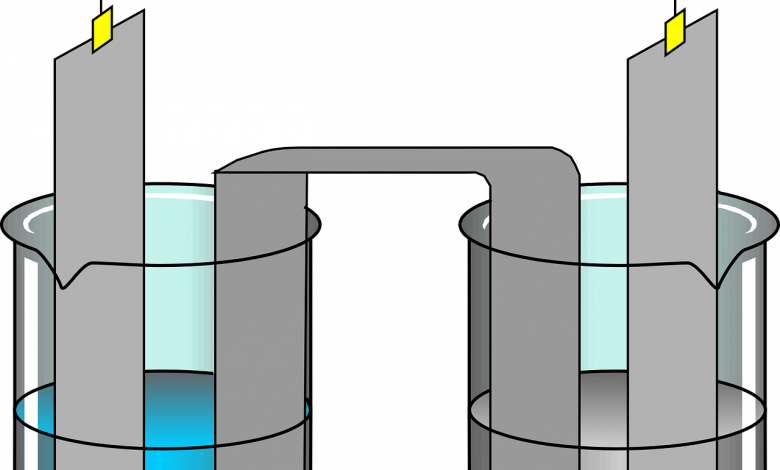
لنفهم بالضبط الكاثود والأنود. يتم تحديد كلاهما من خلال تدفق التيار. لذلك، الكاثود هو قطب كهربائي يخرج منه التيار من جهاز كهربائي مستقطب. وبالمثل، فإنّ الأنود هو قطب كهربائي يدخل منه التيار في جهاز كهربائي مستقطب. الكاثودات والأنودات نوعان من الأقطاب الكهربائية داخل خلية كهربائية تدل على النقطة التي تنتقل فيها الكهرباء إلى الخلية ومن أين تغادر.
لا يتم إصلاح مواقع الكاثود والأنود داخل الخلية ويمكن أن تتغير اعتمادًا على ما يحدث في أي وقت. على سبيل المثال، عند إعادة شحن بطارية قابلة لإعادة الشحن. قد تكون الأنودات والكاثودات في مجال البطارية مربكاً، حيث إنّ وضع العلامات على الجوانب الموجبة والسالبة للبطارية لا يتطابق غالبًا مع الشحنات الخاصة بكل منهما.
ما هو القطب What is an Electrode؟
يُعرف أحد المكونات الأساسية للخلية الكهروكيميائية التي تتلامس مع الإلكتروليت باسم القطب. يعمل القطب كجهة اتصال معدنية يدخل من خلالها التيار الكهربائي ويغادره. وبشكل أكثر تحديدًا، يمكننا القول، أنّه يُنظر إليه على أنّه سطح يحدث فيه تفاعل الأكسدة والاختزال بين المعدن والمحلول.
يمثل القطب الكهربائي عمومًا موصلًا كهربائيًا / شبه موصل داخل الخلية الكهروكيميائية. وهي تحدد المرحلة الموصلة حيث يتم نقل الناقلات المشحونة. القطب الذي يفقد الإلكترونات ويقبله الإلكتروليت يخضع للأكسدة. ومع ذلك، عندما تحدث العملية العكسية، أي عندما يكتسب القطب الإلكترونات التي يتم إطلاقها بواسطة المنحل بالكهرباء “الإلكتروليت”، يخضع للاختزال.
تعريف الكاثود Definition of Cathode:
يشير الكاثود إلى قطب كهربائي داخل خلية كهربائية “إما كلفانية أو إلكتروليتية”، والتي تدخل فيها إلكترونات سالبة الشحنة. يُشار إلى الكاثود دائمًا بالقطب الموجب، على الرغم من وجود شحنة سالبة صافية. هذا بسبب حدوث زيادة موجبة في عدد الإلكترونات في هذا الجانب، ولهذا السبب سيتم دائمًا تمييز جانب الكاثود بالإشارة الموجبة على البطارية، سواء كان قابلاً لإعادة الشحن أم لا.
تُعرف هذه الزيادة في عدد الإلكترونات باسم تفاعل الاختزال (reduction reaction)، حيث يشير هذا إلى انخفاض في حالة أكسدة العنصر. على سبيل المثال، في بطارية ثاني أكسيد الزنك والمنغنيز، وهي أكثر التركيبات الكيميائية شيوعًا لبطارية منزلية، نرى الإلكترونات تنتقل من جزيئات الزنك سالبة الشحنة إلى المنغنيز موجب الشحنة. هذا يعني أنّ جانب ثاني أكسيد المنغنيز للبطارية هو الكاثود الخاص بنا وأنّه مع استهلاك “شحن” البطارية، تصبح أيونات الزنك كاتيونات موجبة الشحنة تنجذب إلى الطرف الكاثود للبطارية وتنتقل عبرها.
من المهم ملاحظة أنّه في بعض الحالات، على سبيل المثال، عند شحن البطارية، ينتهي تغيير القطب الموجب والكاثود. يتم استهلاك الإلكترونات الموجودة في الطرف الموجب للخلية، مما يعني أنّ هناك انخفاضًا في عدد الإلكترونات، لأنّها تتحرك بعيدًا، مما يعني أنّ هذه النهاية هي الآن الأنود.
تعريف الأنود Definition of Anode:
الأنود هو قطب كهربائي داخل خلية كهربائية تنطلق منه الإلكترونات وتتجه نحو جزيئات أخرى في أجزاء مختلفة من الخلية الكهربائية، أو خارج الخلية. دائمًا تقريبًا، على سبيل المثال في البطارية المنزلية، يُطلق على القطب الموجب اسم الجانب السالب للخلية، على الرغم من وجود شحنة موجبة من الإلكترونات تتحرك بعيدًا. يُعرف هذا الانخفاض في عدد الإلكترونات بتفاعل الأكسدة ويعطي الجزيئات الموجودة على جانب الأنود من الخلية الشحنة الموجبة، مما يحولها إلى كاتيونات.
في مثال البطارية، جانب الزنك هو الأنود، حيث تنتقل الإلكترونات من الزنك إلى ثاني أكسيد المنغنيز. بمجرد أن تتلقى جزيئات ثاني أكسيد المنغنيز إلكتروناتها من جزيئات الزنك، فإنّ شحنتها السالبة ستجذبها عبر هذا الجانب من البطارية كأنيونات. عند شحن البطارية، تمامًا كما هو الحال مع القطب السالب، سيتم تبديل موضع الأنود. أثناء الشحن، ستتأكسد مادة الأنود وتتكون الإلكترونات، بينما يتم إزالتها في نفس الوقت من الطرف الآخر للبطارية.
هذا يعني أنّ الإلكترونات تتحرك الآن إلى الخلية الكهربائية عبر الجانب السالب للخلية، مما يعني أنّ هذا الجانب هو الآن الكاثود أثناء شحن البطارية. يؤدي هذا إلى إعادة توزيع الإلكترونات إلى المواضع التي كانت عليها من قبل “على الرغم من أنّها ليست بنفس القدر تمامًا” ويسمح للبطارية بتوفير الشحن مرة أخرى.
ما الفرق بين الكاثود والأنود؟
أوجه المقارنة الأنود الكاثود
الأساس القطب حيث تحدث الأكسدة. القطب حيث يحدث الاختزال.
القطبية الطرفية في خلية التحليل الكهربائي موجبة سالبة
القطبية الطرفية في الخلية الجلفانية سالبة موجبة
السلوك يجذب الأنود في خلية التحليل الكهربائي الأنيونات. الكاثود في خلية التحليل الكهربائي يجذب الكاتيونات.
الطبيعة في الخلية الإلكتروليتية هو مصدر لشحنة موجبة أو متقبل للإلكترون. في الخلية الإلكتروليتية، يعد مصدرًا للشحنة السالبة أو مانحًا للإلكترون.
شرح الاختلافات الرئيسية بين الأنود والكاثود:
العامل الرئيسي للتمايز بين الأنود والكاثود هو أنّ الأنود يتوافق مع القطب حيث يحدث الأكسدة، أي فقدان الإلكترونات. بينما يتوافق الكاثود مع القطب حيث يحدث الاختزال، أي اكتساب الإلكترونات.
الدلالة المحددة للقطب الموجب والكاثود على أنّها سلبية خاطئة. وذلك لأنّ القطبية الطرفية تختلف باختلاف نوع الخلية، أي التحليل الكهربائي أو الكلفاني قيد الاستخدام.
بالنسبة لخلية التحليل الكهربائي، يعمل القطب الموجب كمحطة موجبة بينما يحتفظ الكاثود بقطبية سالبة. وبالتالي، يجذب الأنود الجسيمات المشحونة السالبة بينما الكاثود يجذب الجسيمات المشحونة إيجابياً.
بالنسبة للخلية الجلفانية، يحمل الأنود قطبية سالبة بينما يعمل الكاثود كمحطة موجبة. ومن ثمّ، فإنّ الأنود هنا سوف يجذب الجسيمات المشحونة إيجابياً، وسوف يجذب الكاثود الجسيمات سالبة الشحنة.
أثناء عملية الشحن، في نهاية الكاثود، سنرى تكوين الإلكترونات من خلال أكسدة مادة الأنود، بينما سنرى امتصاصًا وتناقصًا للإلكترونات في نهاية الأنود.
بمجرد أن تبدأ حركة الإلكترونات في الخلية الكهربائية “التفريغ”، ستنجذب الأنيونات الناتجة إلى نهاية الأنود للخلية، بينما تنجذب الكاتيونات إلى نهاية الكاثود.
لقد رأينا أنّ هناك نوعين من الخلايا الكهروكيميائية، وهما الخلايا الجلفانية والإلكتروليتية. اتجاه تدفق التيار هو عكس الاتجاه الذي يتحرك فيه الجسيم سالب الشحنة. في خلية التحليل الكهربائي، يتدفق التيار من القطب الموجب إلى الكاثود. أثناء التواجد في الخلية الجلفانية، يكون اتجاه تدفق التيار من الكاثود إلى الأنود.
"
الكاثود والأنود Cathode and Anode
هل أعجبك هذا المقال؟
