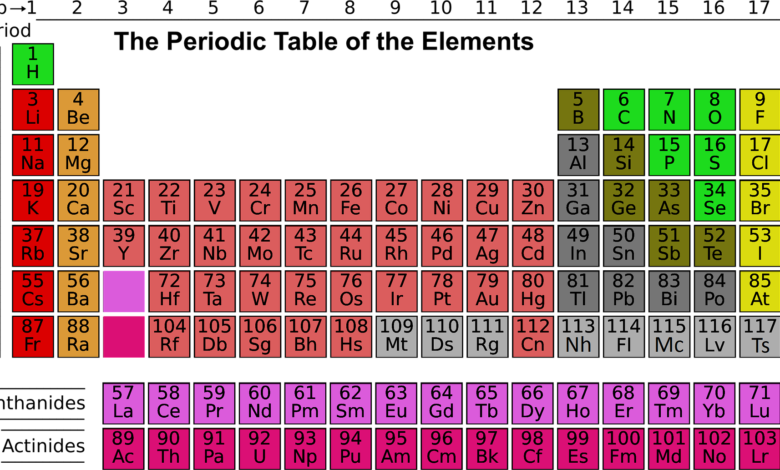
"العناصر القلوية:
خصائص العناصر القلوية:
العناصر القلوية الترابية:
خصائص العناصر الترابية:
العناصر الإنتقالية:
خصائص العناصر الإنتقالية:
العناصر الأرضيّة:
عناصر مجموعة الكربون:
خصائص عناصر مجموعة الكربون:
عناصر مجموعة النيتروجين:
عناصر مجموعة الأكسجين:
الهالوجينات:
خصائص الهالوجينات:
العناصر النبيلة:
خصائص العناصر النبيلة:
العناصر القلوية:
عي عبارة عن عناصر تمتلك في مدارها الأخير إلكتروناً واحداً، تمتاز هذه العناصر بأنّها عناصر معدنيّة صلبة، ذات لمعان وبريق عالي، إضافةً إلى كونها جيدة التوصيل للحرارة والكهرباء.
تشتمل القلويّات على جميع العناصر الموجودة في المجموعة الاولى، بإستثناء عنصر الهيدروجين، حيث تضم كل من الليثيوم والصوديوم والبوتاسيوم والروبيديوم إضافةً إلى السيزيوم والفرانسيوم.
خصائص العناصر القلوية:
عند تفاعل العناصر القلوية مع الماء فإنّ ذرة الهيدروجين تنفصل حتى يتم تكوين الهيدروجين، ولكن هذه الذرة ترتبط مع الأكسجين حتى يتم تكوين الهيدروكسيد.
جميع العناصر الموجودة في المجموعة الاولى لها إلكترون تكافؤ واحد فقط، كما أنّه تتشارك في نفس التفاعلات الكيميائيّة.
تمتاز هذه العناصر بليونتها ولمعانها؛ الامر الذي يجعل تقطيعها سهلاً، إضافةً إلى تميُّزها باللون الأبيض، وفي حال وضعت هذه العناصر في لهبٍ مُشتعل فإنّها ستعطي ألواناً مميزة فمثلاً يتوهج الليثيوم ليعطي اللون الأحمر الفاتح.
يتوفر الصوديوم بشكل كبير على سطح الأرض حيث يحتل المرتبة السادسة، في حين يحتل البوتاسيوم المرتبة السابعة من حيث الوفرة، مما يعني أنّ كل عنصر من عناصر هذه المجموعة يحتل مرتبة خاصة به.
تتواجد هذه العناصر مع عناصر اخرى في الطبيعة، كما أنّها قادرة على تكوين بعض من المعادن البسيطة كالهاليت مثلاً.
تمتاز هذه العناصر بسرعة وسهولة تفاعلها مع الأكسجين وبخار الماء الموجود في الجو، إضافةً إلى تفاعلها بشكل كبير جداً مع الماء حتى يتم انتاج وتكوين الهيدروجين.
عند تفاعل هذه العناصر مع اللافلزات فإنّها ستميل إلى تكوين أيونات موجبة الشحنة؛ الأمر الذي يؤدي إلى تكوين مركبات لها درجات انصهار عالية جداً.
العناصر القلوية الترابية:
تقع هذه العناصر في المجموعة الثانية، تمتاز بأنّها عناصر معدنية، لها بريقاً ولمعاناً أبيض يميل إلى الرماديّ في أغلب الأحيان، كما أنّها من العناصر جيدة التوصيل للحرارة، وهذه العناصر ستة: البيريليوم، المغنيسيوم، الكالسيوم، إضافةً إلى السترونيوم والباريوم والراديوم.
خصائص العناصر الترابية:
يتم استخدام جميع عناصر هذه المجموعة في العديد من المجالات والصناعات خاصةً السبائك باستثناء عنصرالراديوم.
تُعتبر هذه العناصر من العناصر شديدة التفاعل ، مع العلم أنّها أقل تفاعلاً من العناصر القلوية.
لا يمكن أن تتواجد عناصر هذه المجموعة بشكل حر في الطبيعة؛ وذلك نظراً لشدة تفاعلها.
يُعتبر عنصر الراديوم الموجود في هذه المجموعة من العناصر نادرة الوجود والانتشار، إضافةً لامتلاكه عدد من النظائر المُشعة، هذا وقد تم استخدام معظم مركبات هذا العنصر في علاج مرض السرطان بشكل كبير.
تحتوي هذه العناصر على إلكترون تكافؤ موجود في غلافها الخارجي.
تمتاز هذه المجموعة بانخفاض الألفة الإلكترونية والكهروسلبية.
تمتاز بانخفاض كثافتها، إضافةً إلى انخفاض نقطة انصهارها وغليانها.
تعمل عناصر هذه المجموعة على تكوين كاتيونات ثنائيّة التكافؤ بسهولة.
تمتاز العناصر الترابية بانها من العناصر الليّنة والقوية نسبياً.
العناصر الإنتقالية:
تحتوي هذه العناصر على إلكترون تكافؤ قادر على تكوين روابط كيميائية بهيكلين بدلاً من هيكل واحد، تقع هذه العناصر في وسط الجدول الدوريّ، ومن أشهر هذه العناصر: الحديد، النيكل، النحاس، التيتانيوم، الذهب، الفضة، البلاتينيوم إضافةً إلى كل من النيكل والزنك والزئبق والكروم والمنغنيز والنيكل أو التنغستين.
خصائص العناصر الإنتقالية:
تُعتبر هذه العناصر مركبات مُعقدة ومُلونة تظهر بعدة ألوان.
من العناصر القابلة للتأكسد في أكثر من حالة.
لها عوامل مُحفزّة ومُشجعة.
في أغلب الأحيان تأخذ اللون الفضيّ الذي يميل إلى اللون الأزرق.
تمتاز عناصر هذه المجموعة بصلابتها العالية.
تمتاز بقابليتها للسحب والطرق.
من العناصر الموصلة للحرارة والكهرباء بشكل جيد.
حتى يتم انصهار وغليان عناصر هذه المجموعة يجب أن تتوفر درجات حرارة عالية جداً.
العناصر الأرضيّة:
تُشير هذه العناصر إلى المجموعة الثالثة في الجدول الدوري، تحتوي في مدارها الأخير على ثلاثة إلكترونات، ومن أشهر هذه العناصر هو عنصر الألمنيوم، كما أنّها تحتوي على البورون والإنديوم والثاليوم إضافةً إلى النيهونيوم.
عناصر مجموعة الكربون:
يُعتبر الكربون أشهر عناصر هذه المجموعة، يمتاز بقدرته على تشكيل وتكوين أربع روابط، إضافةً إلى أنّ عناصر هذه المجموعة تحتوي في مدارها الأخير على أربعة إلكترونات، ومن أهم عناصر هذه المجموعة إلى جانب الكربون، السيليكون، الجرمانيوم، القصدير، الرصاص، الفليروفيوم.
خصائص عناصر مجموعة الكربون:
تميل معظم عناصر هذه المجموعة إلى فقد إلكترونات كلما زاد حجم الذرة.
تمتاز عناصر هذه المجموعة بقدرتها على التشكيل الإلكتروني الخارجي.
تمتاز مركبات هذه المجموعة بالتكافؤ الرباعيّ.
كل عنصر من عناصر هذه المجموعة تحتوي على طاقة تأين خاصة به.
عناصر مجموعة النيتروجين:
يُعدّ النيتروجين العنصر الأساسي في هذه المجموعة، تحتوي هذه المجموعة على خمسة إلكترونات في مدارها الأخير، يُعتبر كل من الفسفور والزرنيخ والأنتيمون والبزموث والموسكوفيوم العناصر التي تُكوّن هذه المجموعة.
تقع هذه العناصر في المجموعة الخامسة عشر من الجدول الدوري، إضافةً إلى أنّ هذه المجموعة سميت باسم النيكتوجين أو النيكوجين.
عناصر مجموعة الأكسجين:
أشهر عناصر هذه المجموعة هو عنصر الأكسجين، تحتوي هذه المجموعة على ستة إلكترونات في مدارها الأخير، وهذه العناصر هي: الكبريت، السيلينيوم، التيليريوم، االبولونيوم إضافةً إلى عنصر الليفرموريوم.
تتفاعل عناصر هذه المجموعة مع المعادن ليتم تكوين مركبات ثنائية التكافؤ، إضافةً إلى تفاعلها مع الأكسجين حتى يتم تكوين الأكاسيد، هذا وقد تتفاعل عناصر هذه المجموعة مع الهالوجينات حتى يتم تكوين مركبات ثنائية.
الهالوجينات:
تُعبر هذه العناصر عن المجموعة السابعة عشر في الجدول الدوريّ، تعمل هذه العناصر على تكوين الملح عندما تتفاعل مع المعادن، كما أنّها تأخذ أشكالاً مُختلفة فمثلاً يوجد كل من الفلور والكلور على شكل غاز، في حين يتواجد البروم سائلاً، أمّا كل من اليود والأستينات فقد تكون مواد صلبة، هذا وقد يتم العثور على هذه العناصر على شكل جزيئات ثنائية الذرة تتواجد في الحالة الغازية.
خصائص الهالوجينات:
تكون جزيئات عناصر هذه المجموعة ثنائية الذرة.
تمتاز الهالوجينات بقدرتها العالية على النشاط الكيميائيّ.
معظم عناصر هذه المجموعة تتوافر بشكل كبير في الطبيعة.
العناصر النبيلة:
تقع هذه الغازات في المجموعة الثامنة عشر، حيث أنّها بالتحديد تقع في أقصى يمين الجدول الدوريّ، سميت هذه المجموعة بهذا الإسم؛ نظراً لخمولها الكيميائيّ، مما يعني أنّها غير قابلة للتفاعل مع غيرها من العناصر نظراً لامتلاكها عدد الإلكترونات المثاليّ.
يُعتبر كل من عنصر الهيليوم والنيون والآرغون والكريبتون والزينون والرادون عناصر نبيلة، حيث أنّ لكل عنصر من هذه العناصر وظيفةً يقوم بها؛ فمثلاً يتم استخدام عنصر الهيليوم في تعبئة هواء المناطيد والبالونات، في حين يتم استخدام كل من النيون والكريبتون في إضاءة المصابيح الموجودة في دور السينما، وغيرها الكثير من استخدامات هذه العناصر.
خصائص العناصر النبيلة:
لاتحتوي عناصر هذه المجموعة على أيونات موجبة أو سالبة.
تُعتبر هذه العناصر غازات ليس لها لون أو رائحة.
يتام العثور على هذه الغازات على شكل ذرات أحادية ومُنفردة.
تُعتبر هذه العناصر خاملة ومُستقرة.
لا يمكن لهذه العناصر أن تنتج مركبات أخرى.
يتم استخلاص عناصر هذه المجموعة واستخراجها من الهواء عن طريق عملية التقطير.
تمتاز قوى التجاذب بين ذرات هذه العناصر الداخلية بضعفها.
لها درجات غليان وذوبان مُنخفضات بشكل كبير.
تزداد كتلة هذه العناصر الذرية بزيادتها كلما اتجهنا من أعلى إلى أسفل.
تمتاز عناصر هذه المجموعة بقدرتها على الذوبان في الماء.
"
تصنيفات العناصر الكيميائيّة
هل أعجبك هذا المقال؟