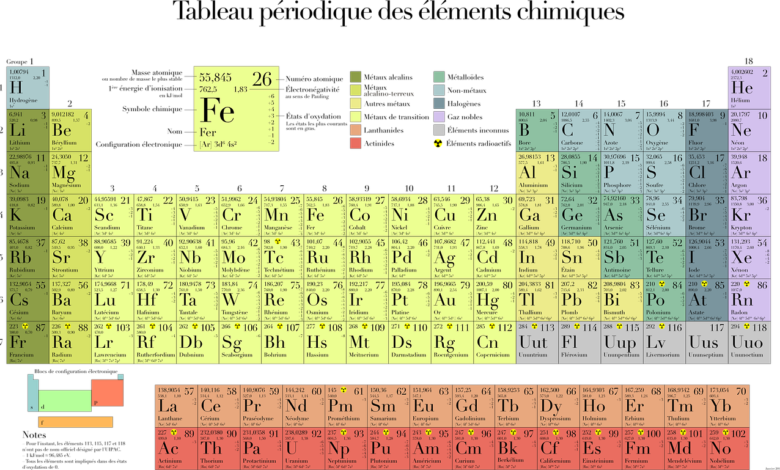
"مفهوم الجدول الدوريّ:
غلاف التكافؤ:
إلكترونات التكافؤ:
الذرة:
مفهوم الدورة:
مفهوم المجموعة:
السلاسل الكيمائيّة:
أهمية الجدول الدوريّ:
خصائص الجدول الدوريّ:
مفهوم الجدول الدوريّ:
هو ترتيب مُوضّح ومُفصّل للعناصر الكيميائيّة، حيث تم هذا الترتيب بناءً على العدد الذريّ للعناصر، وبالاعتماد على توزيعها الإلكترونيّ وخواصّها الكيميائيّة المُتكرَّرة.
تمَّ ترتيب العناصر وتوزيعها في مجموعات ودورات خاصة لكلِّ عنصر، إضافةً إلى أنّه تم وضع الفلزات من جهة اليسار، في حين تكون اللافلزات باتّجاه اليمين، هذا وقد تم وضع العناصر المُتشابهة في سلوكها الكيميائيّ في نفس العمود.
يحتوي الجدول الدوريّ على صفوف وأعمدة، حيث تُمثّل الصفوف عدد الدورات، في حين تُعبِّر الأعمدة عن المجموعات، هذا وقد يحتوي الجدول الدوريّ على ستِّ مجموعات، لكلِّ مجموعة اسم وخصائص تختلف فيها عن المجموعات الأخرى.
وعادةً يتمُّ تنظيم الجدول الدوريّ وترتيبه؛ حتى يتم تحديد العلاقات بين جميع العناصر وخصائصها المُختلفة، إضافةً إلى أنّه يعمل على تحديد السلوكيات والخواص الكيميائيّة للعناصر التي لم يتم اكتشافها حتى الآن.
ظهرت الجداول الدوريّة منذ القِدم، ولكن بشكل مُبسَّط، ومع مرور الوقت بدأت هذه الجداول تتطوّر بشكلٍ تدريجيّ وواضح، حيث إنّها في بداية تطوُّرها بدأت تُبيّن وتُحدِّد الاتِّجاهات الدوريّة لجميع العناصر المُكتشفة والمعروفة.
إضافةً إلى ذلك فقد قامت الجداول الدوريّة المُطوَّرة بتوفير إطارات ومعلومات مُفيدة توضِّح فيها عمليّة تحليل التفاعلات الكيميائيّة التي تحصل بين العناصر، إضافةً إلى أنّ تطوّرها دخل إلى جانب الكيمياء في العديد من العلوم الأخرى والفيزياء النَّوويّة.
يحتوي الجدول الدوريّ على عدد كبير من العناصر حيث يصل عددها إلى ما يقارب”118?عنصراً، حيث توجد مجموعة كبيرة منها في الطبيعة بشكلٍ تلقائيّ، مع ضرورة العلم أنّ هناك عناصر تتواجد بكميّات كبيرة، وهناك مجموعات أخرى توجد في الطبيعة ولكن بنسب ضئيلة نوعاً ما، هذا وقد يتمّ تجهيز وتحضير العناصر المُتبقّية صناعيا في المُختبرات، قبل أن يتمّ الحصول والبحث عنها في الطبيعة.
وكلُّ عنصر من عناصر الجدول الدوريّ يحتوي على عدد ذريّ خاص بهِ، حيث يُمثّل هذا العدد عدد البروتونات التي توجد في نواة العنصر، إضافةً إلى ذلك فإنّ كلَّ عنصر من هذه العناصر قد يحتوي على عدد مُحدّد من النيوترونات التي تختلف تِبعاً لاختلاف ذرَّاته، وتُشير تلك الذَّرَّات إلى مجموعة النظائر الخاصة بالعنصر، حيث إنّ هذه النظائر لا يمكن فصلها أبداً في الجدول الدوريّ، بل يتم تجميعها وربطها مع بعضها بعضاً بشكل دائم.
وهناك مجموعة من العناصر لا تحتوي على نظائر مُستقرّة؛ نظراً لاحتوائها على كُتل ذريّة تكون خاصة بمجموعة النظائر الأكثر استقراراً؛ هذا وقد يتم وضع هذه الكتل بشكل مُوضّح ومُدرّج بين قوسين.
أمّا عن ترتيب العناصر الكيميائيّة في الجدول الدوريّ فإنّه يكون على أساس الزيادة في العدد الذريّ، ممّا يعني أنّ كلَّ صفٍّ جديدٍ يبدأ بالتكوّن عندما يحصل غلاف التكافؤ على أول إلكترون لهُ.
هذا وقد يمتاز الجدول الدوريّ بأهميته، حيث يُعتبر مصدراً مُهمّا للعلماء والطلاب خاصةً الذين يدرسون الكيمياء؛ نظراً لكونه يُساعدهم على تحديد ومعرفة كلِّ ما يتعلَّق بالعنصر، حيث قام العالم مندليف بترتيب وتصنيف العناصر الكيميائيّة في الجدول الدوريّ بالاعتماد على مجموعة من المعايير والأسس، فمثلاً اعتمد في ترتيبهِ على الوزن النوعيّ للعنصر إلى جانب اعتماده بشكل رئيسيّ على عدد العنصر الذري التصاعدي، حيث إنّ لكلِّ عنصر عدد ذريّ يختلف تماماً عن العنصر الآخر.
غلاف التكافؤ:
هو آخر غلاف موجود في الذرة، ويحتوي على عدد الإلكترونات التي تدخل في أيِّ تفاعل يحدث داخل الذرة، كما أنّ هذا الغلاف يضمّ جميع التفاعلات التي تحدث بين روابط هذه الذَّرات، وتسمَّى الإلكترونات الموجودة في هذا الغلاف باسم إلكترونات التكافؤ.
إلكترونات التكافؤ:
هي إلكترونات موجودة في غلاف التكافؤ، وتمتاز هذه الإلكترونات بقدرتها على المُشاركة في التفاعلات الكيميائيّة المُختلفة، وذلك عن طريق الترابط مع عدد من الذرات أو الجزيئيَّات أو الأيّونات المُختلفة، حيث يُساعد هذا العدد على تحديد الخصائص الكيميائيّة للعنصر.
الذرة:
هي أصغر جزء يحتوي عليهِ العنصر الكيميائيّ، ومن السهل الوصول إليهِ، حيث يحتفظ هذا الجزء بجميع الخصائص الكيميائيّة لذلك العنصر، هذا وقد تتكوّن الذرة من مجموعة من الشُّحنات السَّالبة والتي تُعبّر عن عدد الإلكترونات التي تدور حول نواة موجبة الشحنة، فقد تتكوَّن النَّواة من بروتونات موجبة الشحنة ونيوترونات سالبة الشحنة.
مفهوم الدورة:
تُشير الدورة إلى الصف الأفقي الموجود في الجدول الدوريّ، حيث إنّ عدد إلكترونات التكافؤ هي التي تحدّد إلى أي دورة ينتمي العنصر، كما أنّ العناصر الموجودة في نفس الدورة والتي تأتي بشكلٍ مُتتابع قد تمتاز بأنّ لها نفس الكتلة مع وجود اختلاف بسيط في الخصائص الفيزيائيّة.
مفهوم المجموعة:
تُعبّر المجموعة عن الأعمدة الرأسية الموجودة في جدول العناصر الدوريّ، ويصل عدد هذه المجموعات إلى”18? مجموعة، هذا وقد تتشابه هذه المجموعات مع السلاسل الكيمائيّة، حيث يعود السبب الرئيس لانتشار وترتيب الجدول الدوريّ إلى ترتيب وتنظيم هذه السلاسل الكيميائيّة.
السلاسل الكيمائيّة:
هي عبارة عن مجموعة من العناصر الكيميائيّة، حيث تتغيّر صفات وخصائص هذه العناصر بين كلِّ سلسلة والأخرى، هذا وقد يتمّ توزيع هذه السلاسل بشكلٍ رأسيّ، مع ضرورة التأكُّد أنّ هذه السلاسل تم اكتشافها واستخدامها قبل اكتشاف وترتيب الجدول الدوريّ.
أهمية الجدول الدوريّ:
يقوم الجدول الدوريّ بتحديد موقع العنصر؛ حيث إنّه يبيّن إلى أي دورة أو مجموعة ينتمي ذلك العنصر.
يعمل الجدول الدوريّ على تحديد بُنية العنصر الإلكترونيّة.
يقوم بمعرفة سلوك العنصر الكيميائيّ.
يتم من خلاله تحديد طبيعة التفاعلات الكيميائيّة التي يستيطع العنصر أن يرتبط بها.
خصائص الجدول الدوريّ:
يحتوي الجدول الدوريّ على”118? عنصراً كيميائيّاً، ولا يزال البحث مُستمرّاً إلى هذه اللحظات لاكتشاف عناصر جديدة.
مُعظم العناصر المُرتّبة في الجدول الدوريّ عبارة عن معادن، وقد تكون هذه المعادن انتقالية أو ترابية أو قلوية كما أنّها قد تكون أساسية.
يضم الجدول الدوريّ”7? دورات أفقية و”18?مجموعة رأسية.
يتم ترتيب وتصنيف العناصر في الجدول الدوريّ بناءً على الزيادة في العدد الذريّ لتلك العناصر، حيث إنّه كلَّما انتقلنا من اليسار إلى اليمين يقلُّ حجم الذرة، في حين يزداد حجمها عند الانتقال من أعلى لأسفل.
تتشابه عناصر المجموعة الواحدة في خصائصها، إضافةً إلى أنّ لها نفس ترتيب الإلكترونات في المدار الأخير.
العناصر الموجودة في أول ثلاث مجموعات تميل جميعها إلى فقد إلكترونات؛ الأمر الذي يجعلها تُصبح أكثر كهروجاذبيّة.
تميل مُعظم العناصر الموجودة في المجموعات الرابعة والخامسة والسادسة إلى كسب إلكترونات؛ ممّا يعني أنّها ستصبح أكثر كهروسلبيّة.
كل دورة في الجدول الدوريّ تنتهي بعنصر نبيل يمتاز بملْء إلكتروناته في المدار الأخير.
يتم تحديد رقم الدورة التي ينتمي إليها العنصر عن طريق عدد إلكترونات التكافؤ، أو عن طريق عدد الإلكترونات الموجودة في المدار الأخير.
يحتوي الجدول الدوريّ في نهايته على سِلسلتينِ كهربائيتينِ طويلتينِ، كل سلسلة منهما تحتوي على مايقارب”14?عنصراً.
يتم تصنيف عناصر الجدول الدوريّ إلى فلزات أو لافلزات، ويفصل بينهم مجموعة من العناصر أشباه الفلزات.
كلَّما انتقلنا من اليمين إلى اليسار تقلّ كهروسلبية العناصر بشكلٍ تدريجيّ.
"
الجدول الدوري
هل أعجبك هذا المقال؟